Asam, Basa dan Garam (Pelajaran IPA SMP/ MTs Kelas VII)
Asam, Basa dan Garam (Pelajaran IPA SMP/ MTs Kelas VII) ✓ Materi ini mempunyai tujuan supaya teman-teman semua dapat menggolongkan sifat larutan asam, larutan basa, dan larutan garam dengan menggunakan alat dan indikator. Dengan tahu hal tersebut, maka kita dapat mengetahui apa perbedaan antara asam dan basa, tahu pengertian masing-masing, dapat memberi contohnya, dsb.
2. Identifikasi Asam, Basa, dan Garam
3. Penentuan Skala Keasaman dan Kebasaan
4. Rangkuman Materi Asam, Basa dan Garam
5. Contoh Soal Materi Asam, Basa dan Garam
Apa perbedaan sifat asam dan sifat basa? Berikut ini adalah perbedaan antara asam dan basa.
Berikut reaksi kimia yang dapat menghasilkan garam, yaitu:
Manfaat reaksi penetralan bagi manusia misalnya pada produksi asam lambung (HCl) yang terlalu banyak bisa dinetralkan dengan memanfaatkan senyawa basa Mg(OH)2. Proses penetralan bagi para petani supaya tanah yang terlalu asam dan tidak baik untuk tanaman bisa menjadi netral dengan cara menambahkan senyawa basa Ca(OH)2 atau air kapur. Pada pasta gigi yang biasa kita pakai terdapat kandungan basa yang mempunyai fungsi untuk menetralkan mulut kita dari asam, yang mana pada kondisi asam bisa merusak gigi kita dan bisa menyebabkan terjadinya bau mulut.
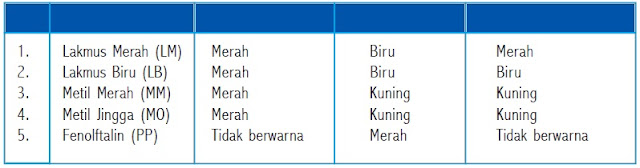
Warna lakmus dalam larutan yang mempunyai sifat asam, basa, dan netral
Lakmus dipakai sebagai indikator asam-basa. Lakmus mempunyai beberapa keunggulan antara lain:
Perhatikan tabel warna ekstrak kubis ungu di bawah ini dalam larutan asam, basa, dan netral.
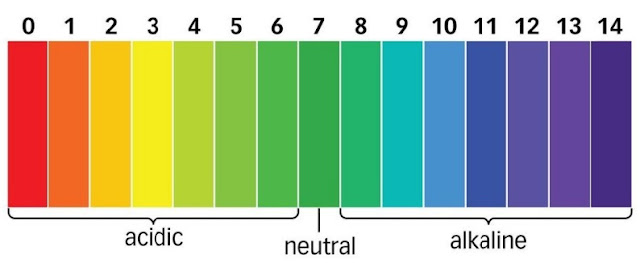
Larutan bersifat netral apabila pH = 7, larutan bersifat asam apabila pH < 7, dan larutan bersifat basa
apabila pH > 7.
2. Contoh benda zat yang bersifat basa adalah sabun.
3. Apabila asam bereaksi dengan basa maka akan membentuk zat netral yaitu zat yang tidak memiliki sifat asam amupun sifat basa. Adapun reaksi antara asam dan basa disebut sebgaai reaksi netralisasi.
4. Senyawa yang terbentuk dari reaksi asam dan basa contohnya adalah garam.
5. Reaksi kimia yang dapat menghasilkan garam, antara lain :
7. Bagi para petani memanfaatkan reaksi penetralan supaya tanah yang terlalu asam dan juga tidak bagus untuk tanaman bisa menjadi netral dengan cara menambahkan senyawa basa Ca(OH)2 atau air kapur.
8. Basa terkandung dalam pasta gigi yang berfungsi untuk menetralkan mulut supaya tidak asam, karena bisa merusak gigi dan menimbulkan bau yang tidak sedap pada mulut.
9. Cara menentukan senyawa bersifat asam, basa atau netral bisa dilakukan dengan memakai kertas lakmus, larutan indikator atau larutan alami.
10. Keuntungan pemakaian lakmus antara lain :
12. Contoh indikator alami antara lain bunga sepatu, kunyit, kulit manggis, kubis ungu atau jenis bunga–bungaan yang berwarna bisa dimanfaatkan untuk menentukan sifat asam atau basa.
13. Indikator universal merupakan campuran dari beraneka macam indikator asam dan basa yang bisa berubah warna setiap satuan pH.
14. Larutan bersifat netral apabila pH = 7, larutan bersifat asam apabila pH < 7, dan larutan bersifat basa apabila pH > 7.
2. Sebutkan contoh zat asam
3. Disebut apa Zat yang dalam air dapat menghasilkan ion hidroksida?
4. Sebutkan contoh zat basa
5. Apa saja sifat asam dan sifat basa
6. Garam yang dihasilkan oleh para petani biasanya menggunakan proses apa?
7. Apa hasil pencampuran antara asam dan basa?
8. Sebutkan contoh garam
9. Sebutkan manfaat reaksi penetralanuntuk manusia
10.Berapa pH Suatu larutan di sebut asam, basa dan netral?
*) Semua Materi IPA SMP Kelas 7 dapat dilihat di : Rangkuman Materi Pelajaran IPA SMP/ MTs Kelas VII
Materi IPA Lainnya :
Daftar Isi
1. Sifat Asam, Basa, dan Garam2. Identifikasi Asam, Basa, dan Garam
3. Penentuan Skala Keasaman dan Kebasaan
4. Rangkuman Materi Asam, Basa dan Garam
5. Contoh Soal Materi Asam, Basa dan Garam
Asam, Basa dan Garam (Pelajaran IPA SMP/ MTs Kelas VII)
Sifat Asam, Basa, dan Garam
Asam
Jika kita makan buah yang masih muda maka panca indera kita (lidah) akan terasa asam. Rasa tersebut disebabkan karena tidak terlepas dari kandungan zat kimia yang ada di dalam buah yang masih muda tersebut. Kandungan tersebut dinamakan zat asam. Pengertian asam adalah zat yang dalam air bisa menghasilkan ion hidrogen (H+).
Contoh asam yang terkenal
Basa
Pengertian basa adalah zat yang dalam air bisa menghasilkan ion hidroksida (OH–). Mengapa dapat terbentuknya ion ion hidroksida? Hal ini karena senyawa hidroksida tersebut bisa mengikat satu elektron pada waktu dimasukkan ke dalam air (H2O). Basa bisa menetralisir asam (H+) oleh karenanya dihasilkan air (H2O). Contoh yang bersifat basa adalah sabun.
Contoh basa yang terkenal
Garam
Terdapat beberapa contoh garam, misalnya saja NaCl, NaNO2, CaCl2, ZnSO4 dan sebagainya. Garam adalah senyawa yang terbentuk dari reaksi asam dan basa. Teman-teman semua pastinya tidak asing lagi dengan garam dapur (NaCl) kan? Garam yang ada di dapur merupakan salah satu contoh garm yang dimanfaatkan untuk memasak. Tahukah teman-teman semua dari mana garam dapur tersebut didapatkan? Garam dapur bisa didapatkan dari air laut. Bagi para petani garam dalam proses membuatnya dengan cara penguapan dan kristalisasi. Garam yang didapatkan lalu diproses iodisasi (garam kalium, KI), oleh karenanya didapatkan garam beriodium. Garam dapur bisa juga didapatkan dengan cara mencampur antara zat asam dan basa. Mengapa hal tersebut bisa demikian? Asam bereaksi dengan basa akan membentuk zat netral, ini berarti bahwa sifatnya tidak asam dan tidak basa. Sedangkan reaksi antara asam dan basa disebut reaksi netralisasi. Sebagai contohnya adalah asam klorida jika bereaksi dengan natrium hidroksida (soda api) akan terbentuk garam dapur dan air. Apabila dalam pembuatan garam memakai proses penguapan, maka air akan mengalami penguapan dan yang tersisa adalah garam dapurnya saja. Logam besi yang terkena garam akan mengalami perubahan benda karena adanya perkaratan.Berikut reaksi kimia yang dapat menghasilkan garam, yaitu:
- Asam + basa --> garam + air
- Basa + oksida asam --> garam + air
- Asam + oksida basa --> garam + air
- Oksida asam + oksida basa --> garam
- Logam + asam --> garam + H2
Contoh garam yang terkenal
Manfaat reaksi penetralan bagi manusia misalnya pada produksi asam lambung (HCl) yang terlalu banyak bisa dinetralkan dengan memanfaatkan senyawa basa Mg(OH)2. Proses penetralan bagi para petani supaya tanah yang terlalu asam dan tidak baik untuk tanaman bisa menjadi netral dengan cara menambahkan senyawa basa Ca(OH)2 atau air kapur. Pada pasta gigi yang biasa kita pakai terdapat kandungan basa yang mempunyai fungsi untuk menetralkan mulut kita dari asam, yang mana pada kondisi asam bisa merusak gigi kita dan bisa menyebabkan terjadinya bau mulut.
Identifikasi Asam, Basa, dan Garam
Penggolongan larutan berdasarkan sifat asam dan basa dapat dibedakan menjadi macam, antara lain : asam, basa, dan netral. Sifat dari larutan tersebut bisa dilihat dengan memakai indikator asam-basa, yaitu zat-zat warna yang dapat memperlihatkan warna berbeda dalam larutan asam dan basa.Warna lakmus dalam larutan yang mempunyai sifat asam, basa, dan netral
Lakmus dipakai sebagai indikator asam-basa. Lakmus mempunyai beberapa keunggulan antara lain:
- Lakmus dapat secara cepat mengaami perubahanna pada waktu bereaksi dengan asam atau dengan basa.
- Lamus tidak mudah bereaksi denfan iksigen di udara sehingga bisa tahan lama.
- Lakmus gampang diserap oleh kertas, sehingga dipakai dalam bentuk lakmus kertas.
Perhatikan tabel warna ekstrak kubis ungu di bawah ini dalam larutan asam, basa, dan netral.
Penentuan Skala Keasaman dan Kebasaan
Semakin suatu zat tersebut mempunyai keasaman yang tinggi, maka semakin banyak ion H+ di dalam air. Sedangkan semakin tinggi tingkat kebasaan zat tersebut, maka semakin banyak ion OH– dalam air. Untuk mengetahui harga pH dan pOH dapat dipakai suatu indikator universal yang bisa menunjukkan warna bermacam-macam untuk setiap pH. Indikator universal dilengkapi dengan cakram warna, dengan demikian warna dan hasil reaksi bisa ditentukan pHnya dengan cara mencocokkan warna tersebut. pH meter juga bisa dipaki untuk menentukan tingkat keasaman atau kebasaan suatu zat. Indikator universal adalah campuran dari berbagai macam indikator asam dan basa yang bisa berubah warna setiap satuan pH. Ada dua macam indikator universal yang dipakai, yaitu berupa larutan dan yang berupa kertas. Pada yang berupa larutan, jika dicelupkan pada larutan yang bersifat asam, basa atau garam yang mempunyai pH berbeda-beda akan menunjukkan warna-warna yang berbeda juga.Larutan bersifat netral apabila pH = 7, larutan bersifat asam apabila pH < 7, dan larutan bersifat basa
apabila pH > 7.
Rangkuman Materi Asam, Basa dan Garam
1. Pengertian asam adalah zat yang dalam air bisa menghasilkan ion hidrogen (H+), sedangkan pengertian basa adalah zat yang dalam air bisa menghasilkan ion hidroksida (OH–).2. Contoh benda zat yang bersifat basa adalah sabun.
3. Apabila asam bereaksi dengan basa maka akan membentuk zat netral yaitu zat yang tidak memiliki sifat asam amupun sifat basa. Adapun reaksi antara asam dan basa disebut sebgaai reaksi netralisasi.
4. Senyawa yang terbentuk dari reaksi asam dan basa contohnya adalah garam.
5. Reaksi kimia yang dapat menghasilkan garam, antara lain :
- Asam + basa, akan menghasilkan garam + air
- Basa + oksida asam, akan menghasilkan garam + air
- Asam + oksida basa, akan menghasilkan garam + air
- Oksida asam + oksida basa, akan menghasilkan garam
- Logam + asam, akan menghasilkan garam + H2
7. Bagi para petani memanfaatkan reaksi penetralan supaya tanah yang terlalu asam dan juga tidak bagus untuk tanaman bisa menjadi netral dengan cara menambahkan senyawa basa Ca(OH)2 atau air kapur.
8. Basa terkandung dalam pasta gigi yang berfungsi untuk menetralkan mulut supaya tidak asam, karena bisa merusak gigi dan menimbulkan bau yang tidak sedap pada mulut.
9. Cara menentukan senyawa bersifat asam, basa atau netral bisa dilakukan dengan memakai kertas lakmus, larutan indikator atau larutan alami.
10. Keuntungan pemakaian lakmus antara lain :
- Lakmus bisa berubah warna secara cepat pada saat bereaksi dengan asam ataupun dengan basa.
- Lakmus sukar bereaksi dengan oksigen dalam udara, oleh karenanya bisa tahan lama.
- Lakmus dapat dengan mudah diserap oleh kertas, sehingga dapat digunakan dalam bentuk lakmus kertas.
12. Contoh indikator alami antara lain bunga sepatu, kunyit, kulit manggis, kubis ungu atau jenis bunga–bungaan yang berwarna bisa dimanfaatkan untuk menentukan sifat asam atau basa.
13. Indikator universal merupakan campuran dari beraneka macam indikator asam dan basa yang bisa berubah warna setiap satuan pH.
14. Larutan bersifat netral apabila pH = 7, larutan bersifat asam apabila pH < 7, dan larutan bersifat basa apabila pH > 7.
Contoh Soal Materi Asam, Basa dan Garam
1. Apa nama Zat yang dalam air dapat menghasilkan ion hidrogen positif?2. Sebutkan contoh zat asam
3. Disebut apa Zat yang dalam air dapat menghasilkan ion hidroksida?
4. Sebutkan contoh zat basa
5. Apa saja sifat asam dan sifat basa
6. Garam yang dihasilkan oleh para petani biasanya menggunakan proses apa?
7. Apa hasil pencampuran antara asam dan basa?
8. Sebutkan contoh garam
9. Sebutkan manfaat reaksi penetralanuntuk manusia
10.Berapa pH Suatu larutan di sebut asam, basa dan netral?
*) Semua Materi IPA SMP Kelas 7 dapat dilihat di : Rangkuman Materi Pelajaran IPA SMP/ MTs Kelas VII
Materi IPA Lainnya :
1. Rangkuman Materi Pelajaran IPA SD/ MI Kelas VItulah artikel tentang materi kelas 7 yag berjudul Asam, Basa dan Garam (Pelajaran IPA SMP/ MTs Kelas VII) yang semoga bermanfaat.
2. Bumi dan Alam Semesta